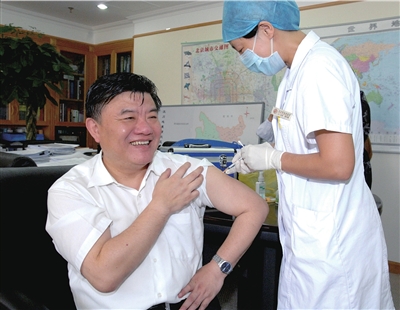
衛生部長陳竺11日在辦公室試種第二針國產甲流疫苗。 衛生部供圖
陳竺率先試種第二針甲流疫苗 全國13300多名志願者將試種第二針 其中北京1513人已試種
今天起,中國自行研制的甲流疫苗臨床試驗受試者開始接種第二針。衛生部部長陳竺作為第一個受試者,已于11日下午率先完成第二針接種。
昨天,記者從衛生部獲悉,國產甲流疫苗臨床試驗工作進展順利。在完成對受試者接種第一針甲流疫苗的初步安全性分析報告後,全國13300多名甲流疫苗臨床試驗受試志願者將陸續接種第二針,整個臨床試驗預計將在9月中旬完成。
北京1513人已打第二針
據了解,我國甲流疫苗在7月份開始臨床試驗,所有的臨床試驗都是在中國疾病預防控制中心指導下進行的。目前,國內共有北京科興、華蘭生物等10家流感疫苗生產企業生產的甲流疫苗進入臨床試驗,受試者達到13300多人。
記者從北京科興生物制品有限公司了解到,昨天下午,北京地區的1513名受試志願者已經率先接種了由該公司生產的第二針甲流疫苗。接種程序規定,志願者中老年組僅接種一針;成人組、少年組和兒童組需要接種兩針。
科興公司總經理尹衛東介紹,此次臨床試驗採取單中心、隨機雙盲對照設計,受試者在接種前都簽署了知情同意書,他們只知道接種了疫苗,但不知道接種了何種劑型何種劑量的疫苗,以保證疫苗臨床試驗的嚴謹、科學、符合倫理要求。接種完第二針後,志願者還需要再接受兩次採血,用以檢測疫苗安全性和志願者身體狀況。
尹衛東表示,志願者們的參與將為今後接種甲流疫苗提供安全性和有效性數據,甲流疫苗能夠早日投入使用,志願者們功不可沒。
9月完成臨床試驗
中國疾病預防控制中心主任王宇介紹,在受試者接種第二針後,衛生部專家組將在8月中旬對我國甲流疫苗的安全性進行初步研判,我國整個的甲流疫苗臨床研究預計在9月完成。
屆時,衛生部將根據疫情的最新進展來確定疫苗的免疫接種策略和方案。目前,衛生部正持續、密切關注我國甲流疫情的發展,並隨時跟蹤世界衛生組織和各個國家的疫苗研發和使用情況,根據疫情發展隨時調整疫苗的使用策略。
疫苗暫無嚴重不良反應
衛生部昨日表示,在甲流疫苗第一針接種後的臨床試驗安全觀察中,沒有發現嚴重不良反應或事件。此後的初步安全性分析報告也顯示,我國生產的甲流試驗用疫苗安全可靠。
王宇稱,我國甲流疫苗的研發遵守的首要原則是“安全”。不僅在臨床試驗中要遵循科學、有序、安全的策略,在臨床試驗結束後,衛生、藥監等有關部門也將持續關注甲流疫苗的生產、臨床使用安全。
衛生部稱,我國甲流疫苗的研發是與世界同步的,之所以在很短的時間內順利進入臨床試驗階段,在于政府、企業、技術研發機構、醫療單位等方面的緊密團結和合作。(記者葉洲)
相關鏈接
衛生部長陳竺係試驗接種第一人
昨天,記者從有關方面獲悉,作為我國第一個甲流疫苗受試者,衛生部部長陳竺前天下午在其辦公室內接種了第二針疫苗。
陳竺于7月21日中午接種了第一針用于臨床研究的試驗疫苗,隨後北京、江蘇的4000多名志願者在7月22日開始大規模接種。從接種時間看,陳竺是中國乃至全球接種甲型H1N1流感疫苗第一人,他的接種時間比大規模接種的一般志願者早。
據負責為陳竺接種的工作人員介紹,每次為陳竺注射疫苗(2次)或抽血化驗(3次)的時候,他都是滿臉笑容,表現得信心十足。陳竺曾私下告訴工作人員,之所以率先接種國產的甲流疫苗,就是要表明自己的信心和決心,他相信中國生產的疫苗質量不比國外跨國公司的差。
這位工作人員說,陳竺以志願者的身份參與甲型H1N1流感疫苗臨床研究,說明了他對這項研究的重視與支持,“讓我們這些參與研究的人很感動。”
藥物受試者可隨時退出研究
國家藥監局昨天公布《倫理委員會藥物臨床試驗倫理審查工作指導原則》,向社會公開徵求意見。指導原則規定,為保護藥物臨床試驗受試者的合法權益,受試者可以拒絕參加或在任何時候退出研究。
指導原則指出,研究者須向受試者說明研究性質、研究目的、可能的受益和風險;一旦發生與研究有關的傷害事件,受試者可能獲得的補償或治療;如果存在,預計按比例支付給受試者參加研究的費用;受試者參加研究應屬自願,受試者可以拒絕參加或在任何時候退出研究而不會因此受到處罰或其應得利益不會遭受損失。(記者葉洲)
